-
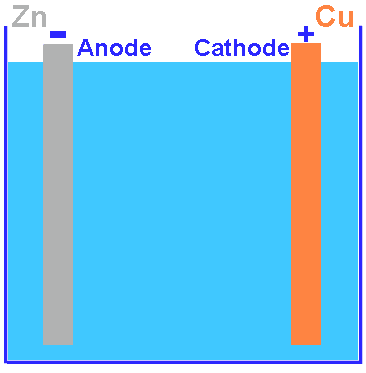
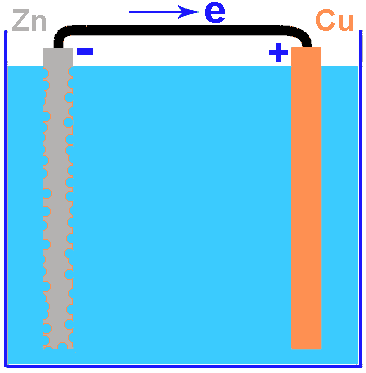
Introduction: les piles et l'électronégativité des métauxAvant de parler de la protection galvanique des navires, je dois vous parler des piles électriques. La première pile est la pile de Volta, constituée d'un empilement de petits disques de zinc et de cuivre, séparés par un feutre imprégré d'une solution de sel. Toutes les piles plus modernes sont basées sur ce principe: deux métaux dissimétriques et un électrolyte.Quand la pile débite du courant (le circuit électrique est fermé), les disques de zinc sont oxidés et se dissolvent lentement dans l'électrolyte. Quand la pile ne débite pas de courant, la charge négative qui apparait sur l'électrode empèche l'oxidation. Quand le circuit est fermé, la charge peut se dissiper via le conducteur et l'oxidation peut recommencer. Les deux dessins à droite ne représentes pas exactement une pile de Volta (qui est en fait un empilement d'éléments), mais les composants sont les mêmes. La différence entre une pile et un accu, est que la réaction est inversible avec un accu. Avec une pile la recharge n'est pas possible parce que le zinc oxidé entre dans la solution et quand il est réduit il ne se dépose pas bien sur l'électrode mais forme es dendrites qui vont cours-circuiter la pile (cette pile de Volta a encore d'autres inconvénients que nous n'allons pas discuter ici). Mais cette réaction d'oxidation peut également se produire dans d'autres cas: il faut pour cela:
Magnésium Manganèse Aluminium Zinc Chrome Fer Cuivre Nickel Argent Etain Mercure Platine Or Carbone Comme les métaux moins électropositifs ne sont pas attaqués, on les appelle "nobles". Dans le couple Fer-Zinc, c'est le zinc qui est attaqué, mais dans le couple Fer-Nickel c'est le fer qui est attaqué. Le fer qui est attaqué se transforme en rouille (c'est l'oxide de fer). Le problème avec le fer, c'est que son oxide grossit énormément et se détache du fer, mettant une nouvelle partie à nu. Dans le cas de l'oxidation de l'aluminium, du chrome et d'autres métaux il se forme une couche d'oxide qui ne grossit pas. Cette couche reste collée au métal et le protège de l'oxidation.
La protection de la coque des naviresLa coque des navires est généralement en acier. Mais l'acier est composé de fer, de carbone et d'autres métaux en alliage (nous considérons le carbone comme étant un métal par une de ses caractéristiques: il est conducteur).Nous avons donc tous les éléments pour créer une pile électrique, notamment deux métaux dissemblables en contact, plongés dans un électrolyte (de l'eau de mer ou de l'eau saumatre). Sans système de protection la coque serait rapidement attaquée. Il n'est ici pas possible de mesurer une différence de potentiel, puisque le fer et le carbone sont mélangés dans l'acier. Dans une pile avec une électrode en fer et une électrode en carbone on obtient une différence de potentiel, avec l'électrode en fer plus négative (c'st l'anode) qui sera attaquée quand la pile débite. Une pile saline classique a le pôle positif en carbone (c'est la petite électrode) tandis que le pôle négatif est l'extérieur de la pile en zinc. Quand la pile débite, c'est le zinc qui est attaqué. La pile peut facilement fuir quand il n'y a plus de zinc à l'atat métallique. Les piles zinc-carbone (piles salines) sont expliquées ici. Le système le plus simple qui est utilisé pour les petits navires et les navires en polyester comme les anciens chasseurs de mines de la classe Aster (Eridan pour les français) est d'utiliser des blocs de zinc placés autour des endroits qui sont le plus sujet à corrosion (à la poupe du navire). Sur les chasseurs de mines ces blocs servent à protéger l'hélice en bronze, c'est pratiquement la seule partie en métal immergé. Pour fonctionner correctement les blocs en zinc doivent être reliés à la masse du navire (masse électrique) et à toutes les parties susceptibles d'être attaquées (axe de l'hélice dans le cas des chasseurs de mines). Si on coupe la liaison électrique entre les blocs en zinc et la masse du navire on peut mesurer une légère différence de potentiel. Ces blocs en zinc sont attaqués et disparaissent à la longue. On en profite de l'entretien en cale sèche pour les remplacer. Ces blocs en zinc sont aussi appellés anodes sacrificielles car elles se sacrifient au profit des autres parties en métal du navire.
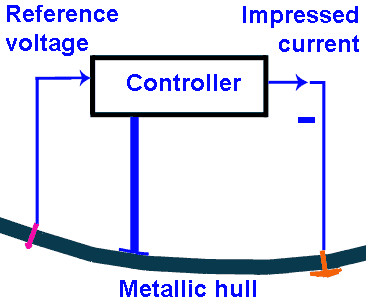
Protection activePour les grands navires les anodes sacrificielles ne suffisent plus, surtout si le navire a voyagé et que la couche de peinture n'est plus bonne. Il faudrait tellement d'anodes que le système ne serait plus pratique.Mais qu'est ce que les anodes sacrificielles produisent? Elles produisent une différence de potentiel (et donc un courant, puisque le circuit électrique est fermé) qui va protéger l'acier. Dans les systèmes actifs, on va créer cette différence de potentiel en utilisant des électrodes connectées à une source de courant. Ces électrodes sont en platine recouvert d'une fine couche d'iridium. Les électrodes ne se corrodent pas, bien qu'elles aient la fonction des blocs de zinc. Les électrodes sont actives non par par leur réactivité (ce sont des métaux très nobles), mais par la tension négative qui est appliquée aux électrodes. Comme l'eau est un bon conducteur, il faut envoyer un courant de plusieurs ampères dans les électrodes, même si la tension est très basse. Dans certains cas bien spécifiques on utilise malgré tout aussi des blocs de zinc, même si le navire dispose d'un système de protection actif. Par exemple dans le cas de navires en construction ou à l'entretien, quand le système de protection actif ne peut pas être utilisé (pas d'alimentation électrique). On utilise un filet en métal avec des blocs de zinc et le filet est relié électriquement à la coque du navire. Sur les grands navires le système de protection actif (protection active à courant imposé ou ICCP: Impressed Current Cathodic Protection) rend le navire très visible aux mines sous-marines qui peuvent détecter la différence de potentiel. De plus l'hélice en rotation produit une ondulation très typique de champ électrique, permettant même de déterminer le type de navire. Il faut donc limiter le courant de protection au strict minimum, aussi parce qu'un courant trop important produit un dégagement d'hydrogène sur la cathode (coque en acier). Ce dégagement d'hydrogène peut rendre l'acier friable à la longue. Le navire peut ainsi être trop peu protégé (il va rouiller) ou trop protégé ("overprotected") pas bon non plus pour la coque. Le courant optimal est déterminé par une seconde électrode qui va mesurer le potentiel de l'acier par rapport à l'eau. L'électrode de mesure est en argent et produit une tension de référence très stable par rapport à l'eau, ce qui permet de déterminer la tension de l'acier par rapport à l'eau par une simple soustraction. Le fonctionnement correct de l'électrode de référence peut être déterminé par comparaison à la tension des autres électrodes de référence si le navire a plusieurs systèmes de protection. On peut également utiliser une électrode de référence portable qu'on immerge dans l'eau à proximité de l'électrode de référence à tester. Toutes les mesures sont effectuées par rapport à la masse du navire. Les grands navires ont plusieurs systèmes de protection active à courant imposé, chaque fois composé d'un générateur de courant, d'une ou de plusieurs anodes de protection et d'une électrode de référence. Ce système de protection n'est pas limité aux navires militaires, mais est d'application sur tous les navires à coque métallique. |
Publicités - Reklame